李仕穎/成紅/余細(xì)勇ACS Nano:自遞送光免疫刺激劑實現(xiàn)光動力增敏的腫瘤免疫治療
發(fā)布時間:2021-10-11 10:51:13 人氣:1168

將光敏劑和免疫調(diào)節(jié)劑自遞送至腫瘤部位,可改善光動力免疫療法,但這一策略仍具有挑戰(zhàn)性。在此,廣州醫(yī)科大學(xué)李仕穎教授、余細(xì)勇教授和南方醫(yī)科大學(xué)成紅副教授聯(lián)合報道了一種用于光動力增敏腫瘤免疫治療的自遞送光免疫刺激劑。
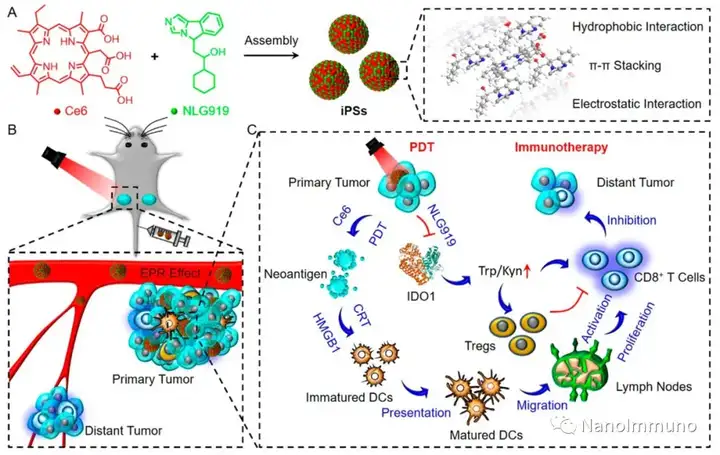
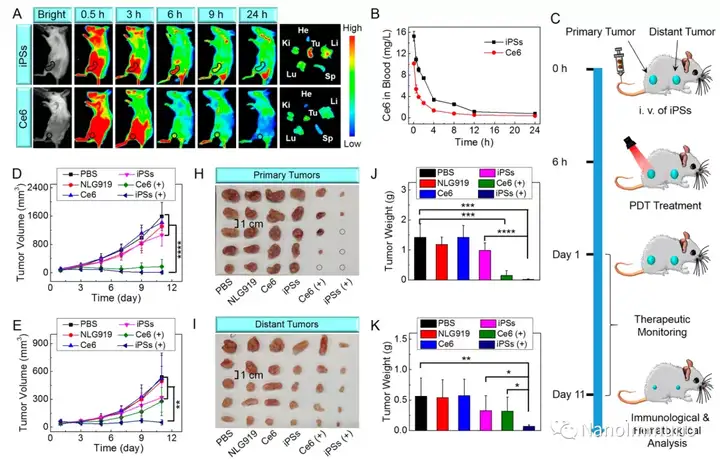
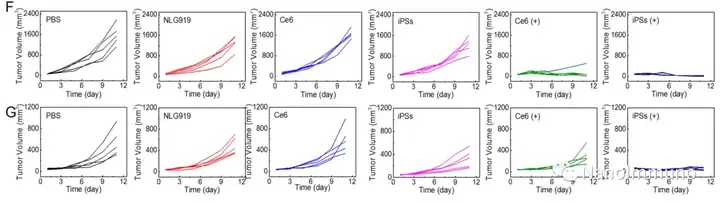
無載體的iPS是通過光敏劑Ce6和NLG919之間的非共價相互作用而自組裝制備的,避免了輔料引起的毒性和免疫原性。靜脈注射后,iPS傾向于被動蓄積在腫瘤部位,以觸發(fā)強大的光動力治療,并誘導(dǎo)免疫原性細(xì)胞死亡,激活了細(xì)胞毒性T淋巴細(xì)胞并啟動了抗腫瘤免疫反應(yīng)。同時,NLG919的共遞送抑制了吲哚胺2,3-雙加氧酶1的激活,逆轉(zhuǎn)了免疫抑制的腫瘤微環(huán)境。基于iPS的光動力增敏免疫療法可有效抑制原發(fā)性和遠(yuǎn)端腫瘤生長,且系統(tǒng)毒性低,為開發(fā)用于腫瘤精準(zhǔn)治療的可臨床轉(zhuǎn)化自遞送納米藥物帶來了啟發(fā)。
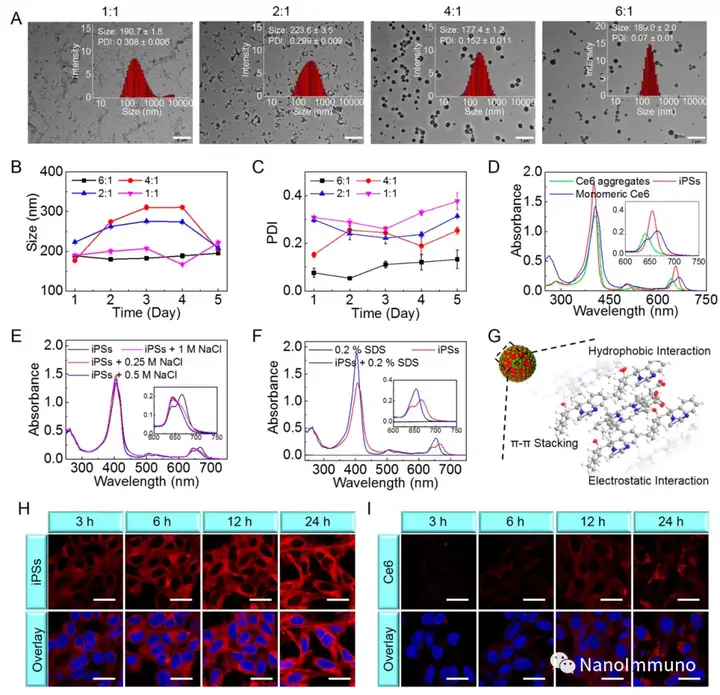
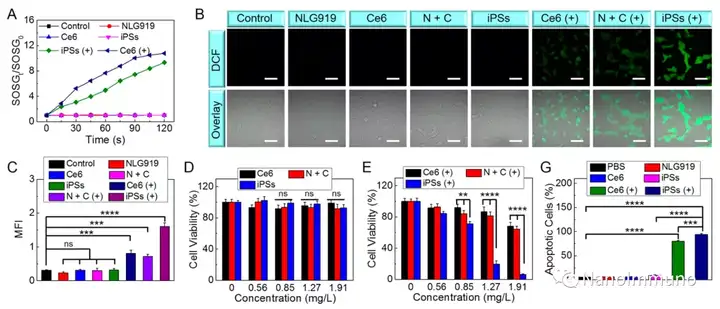
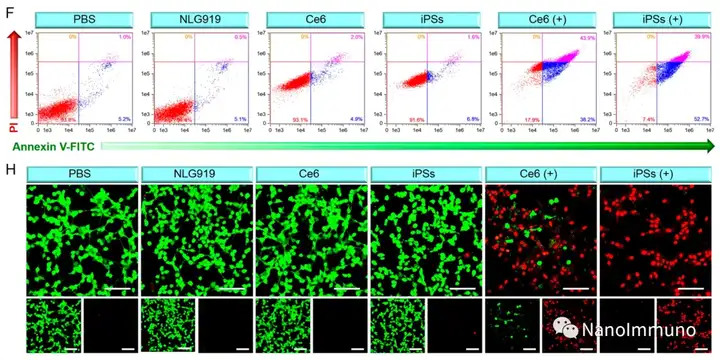
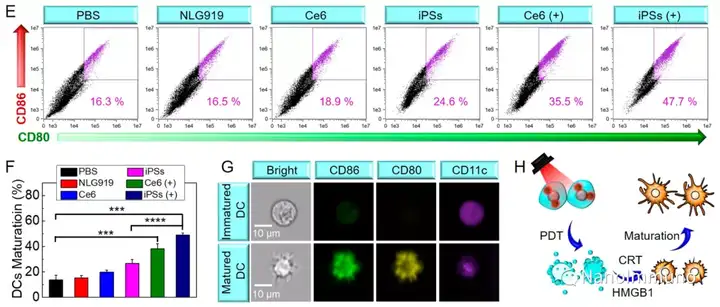
本文通過光敏劑Ce6和NLG919的自組裝制備了用于光動力增敏腫瘤免疫治療的自遞送光免疫刺激劑。由于疏水,π-π堆積和靜電相互作用,自組裝的iPS具有改善的溶解度、穩(wěn)定性和生物相容性。此外,無載體的iPS具有很高的載藥率,可避免潛在的免疫原性。有趣的是,iPS的強大PDT治療不僅可以觸發(fā)腫瘤細(xì)胞凋亡,還可以通過促進鈣網(wǎng)蛋白向細(xì)胞表面遷移和高遷移率族蛋白B1的細(xì)胞外釋放引發(fā)ICD反應(yīng)。成熟的DC將募集并激活CTL,實現(xiàn)了原發(fā)和遠(yuǎn)端腫瘤的協(xié)同免疫治療。NLG919的共同遞送抑制了IDO-1的激活和Treg的腫瘤浸潤,從而逆轉(zhuǎn)了免疫抑制腫瘤微環(huán)境。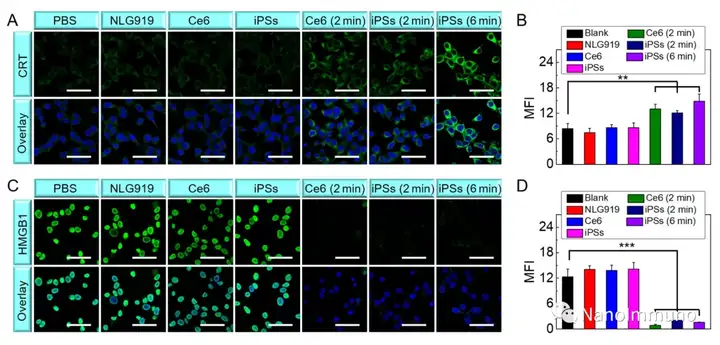
本信息源自互聯(lián)網(wǎng)僅供學(xué)術(shù)交流 如有侵權(quán)請聯(lián)系我們立即刪除
| 溫馨提示:蘇州北科納米供應(yīng)產(chǎn)品僅用于科研,不能用于人體,不同批次產(chǎn)品規(guī)格性能有差異。網(wǎng)站部分文獻案例圖片源自互聯(lián)網(wǎng),圖片僅供參考,請以實物為主,如有侵權(quán)請聯(lián)系我們立即刪除。 |


