【綜述】江蘇大學(xué)陶志敏、許文榮教授ADDR:細(xì)胞外囊泡作為納米/微米尺度的遞送系統(tǒng)
發(fā)布時(shí)間:2021-09-26 10:36:17 人氣:1383
圖1 細(xì)胞外囊泡的生物起源與細(xì)胞攝取
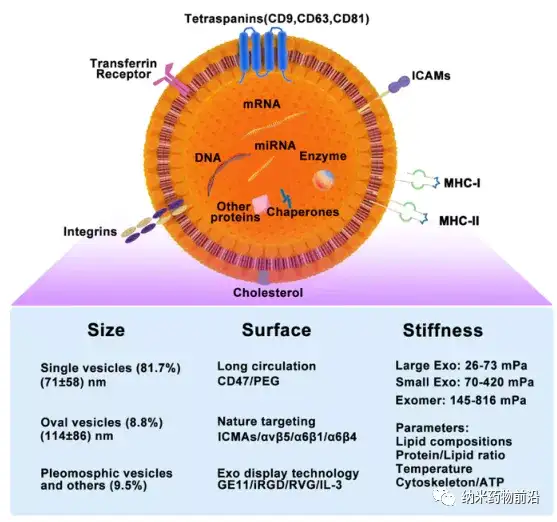
圖2 外泌體的結(jié)構(gòu),內(nèi)容物,生物力學(xué)性質(zhì)。外泌體具有脂質(zhì)雙層膜結(jié)構(gòu),且其膜表面高表達(dá)四跨膜蛋白 CD9、CD81 和 CD63 、豐富的四跨膜蛋白相關(guān)蛋白 ICMA、整聯(lián)蛋白等。大量的 DNA、不同種類RNA、酶和其他功能性蛋白質(zhì)被包裹在外泌體中。
綜述展示的用原子力顯微鏡 AFM 測量EV機(jī)械性能的原理示意圖以及紅細(xì)胞EV的原子力顯微鏡圖像。水通道蛋白-1 AQP1 在EVs上的表達(dá)可以增加其變形能力,AQP1缺失型EV的剛度明顯高于對照EV。此外,對EV進(jìn)行超速離心和超聲波處理,可以在一定程度上改變其剛性。表面改性 例如,通過聚合物或脂質(zhì)功能化 也會(huì)改變EV的機(jī)械性能,與合成顆粒類似,改變聚合物類型、長度、密度/覆蓋率或改變磷脂組成/相行為,會(huì)改變一系列由機(jī)械性能決定的物理化學(xué)特征,包括粒徑、形狀、化學(xué)成分和表面配體,從而改變EV的遞送效率。
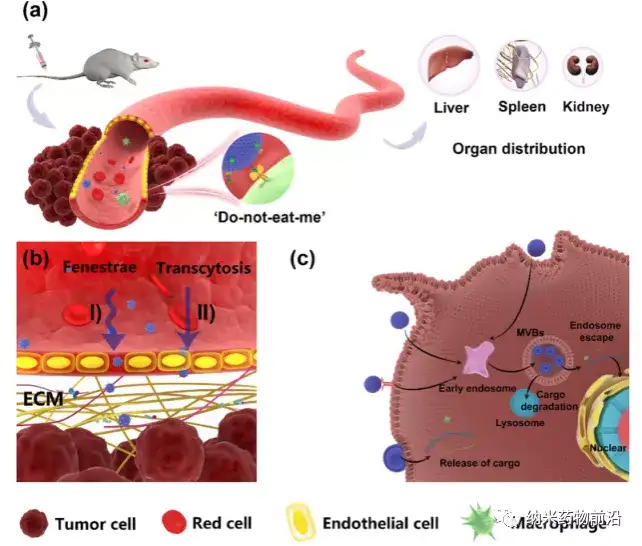
EV 在腫瘤藥物遞送過程中的生物體循環(huán)。(a) EVs 通過尾靜脈注射到小鼠體內(nèi)后,主要在肝臟、脾臟和腎臟中積累。CD47在其表面表達(dá)有助于抵抗巨噬細(xì)胞的吞噬作用。(b) EVs 通過兩種途徑穿透血管內(nèi)皮細(xì)胞:(1) EVs 的可變形性允許它們通過內(nèi)皮間窗孔被動(dòng)外滲;(2) 跨胞運(yùn)輸是內(nèi)皮細(xì)胞主動(dòng)攝取 EVs,然后通過胞吐作用釋放貨物(c) EVs 通過膜融合的EV被細(xì)胞攝取后可以直接釋放貨物。
參考文獻(xiàn)
[1] P. Fu, J. Zhang, H. Li, M. Mak, W. Xu, Z. Tao, Extracellular vesicles as delivery systems at nano-/micro-scale, Adv Drug Deliv Rev, (2021) 113910.
本信息源自互聯(lián)網(wǎng)僅供學(xué)術(shù)交流 如有侵權(quán)請聯(lián)系我們立即刪除
| 溫馨提示:蘇州北科納米供應(yīng)產(chǎn)品僅用于科研,不能用于人體,不同批次產(chǎn)品規(guī)格性能有差異。網(wǎng)站部分文獻(xiàn)案例圖片源自互聯(lián)網(wǎng),圖片僅供參考,請以實(shí)物為主,如有侵權(quán)請聯(lián)系我們立即刪除。 |


